Dissolution, solubilité, solution
I. Exemple
On met un peu de sucre solide dans de l’eau, on agite et le mélange obtenu est homogène : on ne voit qu’une seule partie à l’œil nu donc on ne voit plus le sucre placé dans l’eau. On dit que le sucre s’est dissout dans l’eau ou alors que le sucre est soluble dans l’eau. Quand on a fait ce mélange, on a réalisé une dissolution et le mélange est devenu homogène : on appelle ce mélange une solution.
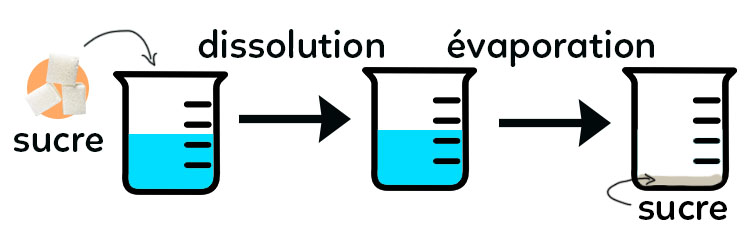
Pour récupérer le sucre solide ou pour prouver que le sucre était bien présent dans l’eau, on peut laisser le mélange à l’air libre pendant quelques temps. L’eau va naturellement s’évaporer et on va récupérer le sucre cristallisé au fond du récipient. Cette technique est utilisée avec l’eau de mer dans les marais salants pour récupérer le sel de l’eau de mer, que l’on consomme tous les jours.
La dissolution est possible dans l’eau pour les solides (sucre, sel), les liquides (colorants, encre) et les gaz (naturellement pour les eaux gazeuses ou l’eau du robinet par exemple).
II. Propriétés
Il y a deux propriétés dans la dissolution :
On place un morceau de sucre dans l’alcool de pharmacie et un morceau de sucre dans une même quantité d’eau, dans deux récipients différents. Le morceau de sucre va entièrement se dissoudre dans l’eau alors qu’il ne va pas ou très peu se dissoudre dans l’alcool. En fait, la solubilité des liquides, gaz ou solides dépend du liquide dans lequel on va les placer.
Dans le cas du sucre, on ne peut pas dissoudre n’importe quelle quantité de sucre dans un litre d’eau. Par exemple, on peut dissoudre au maximum 2 kg de sucre dans un litre d’eau. Si on met 2 kg de sucre plus 1 g, le gramme restant ne sera pas dissout et restera au fond du récipient.